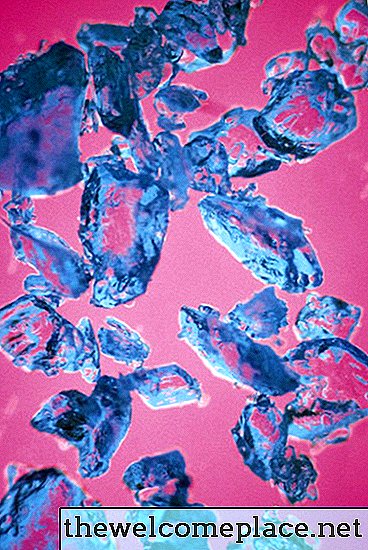
Kuten monet siirtymämetallikompleksit, myös kupari (II) sulfaattipentahydraatti on kirkkaanvärinen; tämän kauniin aineen kiteet ovat vaalean sinisen sävyä. Sen väri johtuu koostumuksensa kemiasta ja fysiikasta - tai tarkemmin sanottuna siitä, millaisia sidoksia se muodostaa kupariin kiinnittyneiden sulfaatti-ionien ja vesimolekyylien kanssa.
 Kuparisulfaattipentahydraatilla on kaunis läpikuultava sininen väri.
Kuparisulfaattipentahydraatilla on kaunis läpikuultava sininen väri.Orbitals
Elektroneilla on aalto-hiukkasten kaksinaisuus, mikä tarkoittaa, että niillä on sekä aaltomaisia ominaisuuksia että hiukkasmaisia ominaisuuksia. Elektronin käyttäytyminen atomissa kuvataan aaltomaisella yhtälöllä, jota kutsutaan aaltofunktiona. Aaltofunktion neliö antaa todennäköisyyden, että elektroni löytyy missä tahansa tietyssä pisteessä milloin tahansa. Atomien elektronien aaltofunktioita kutsutaan myös atomiorbitaaleiksi. Kemistit nimeävät atomiorbitaalit käyttämällä numeroa, joka määrittelee kiertoradan energiatason, ja seuraa kirje, joka osoittaa kiertoradan tyypin. Jaksotaulukon neljännen jakson tai sitä uudempien elementtien kohdalla sinun on keskityttävä vain kolmen tyyppisiin kiertoradalle, nimittäin s, p ja d. Katso linkki resurssiosassa saadaksesi tuntea näiden kiertoratojen muoto.
Kristallikentän halkaisu
Kupari-ioni kupari (II) sulfaatissa on menettänyt kaksi elektronia, joten sillä on +2 varaus. Sillä on yhdeksän elektronia uloimmassa energiatasossaan tai kuoressaan; nämä niin sanotut valenssielektronit miehittävät kaikki 3D-kiertoradat. Vesimolekyylejä ja sulfaatti-ioneja houkuttelee kupari-ionin positiivinen varaus, joten ne lähestyvät sitä ja järjestävät sen ympärille oktaedrisessa muodossa. Sen seurauksena kaksi kupari-ionin viidestä 3D-orbitaalista kohdistuu akseleita pitkin, joilla sulfaatti-ionit ja vesimolekyylit lähestyvät; koska molemmilla elektronilla näillä kiertoradalla ja molekyyleissä / ioneissa olevilla elektroneilla on negatiivinen varaus, ne hylkivät toisiaan. Viime kädessä sitten kahdella viidestä 3D-kiertoradalta on lisääntynyt energia; näitä kutsutaan esimerkiksi orbitaaleiksi. Kolmella muulla on sitä vastoin vähentynyt energia ja niitä kutsutaan t2g-kiertoradaksi.
Valon imeytyminen
Koordinointikompleksi absorboi valon fotonin, jos sillä on energiaa, joka vastaa elektronin nyt käyttämän tilan ja sen käytettävissä olevan toisen tilan energian välistä eroa. Tämän seurauksena kuparisulfaattikompleksi voi absorboida valon fotoneja energioilla, jotka vastaavat t2g: n ja esim. Kiertoraalien välistä energiaeroa. Kuten tapahtuu, kuparisulfaattikompleksin energiaero on yhtä suuri kuin spektrin punaoranssin alueen valon fotonien energiaero. Koska punertava valo absorboituu, kun sininen valo läpäisee, kuparisulfaatti näyttää siniseltä.
Liukenee veteen
Kun kuparisulfaatti liukenee veteen, kupari- ja sulfaatti-ionit dissosioituvat. Nyt kupari-ioni muodostaa oktaedrisen kompleksin, jossa sitä ympäröivät kuusi vesimolekyyliä. Vaikutus on kuitenkin edelleen suurin piirtein sama, koska t2g-orbitaalien ja esim. Orbitaalien välinen jakautuminen tässä uudessa kompleksissa on edelleen sellainen, että punertavanoranssi valo absorboituu ja näet sinisenvärisen ratkaisun.